|
|
本文来源:药明康德
骨髓瘤之家引用的目的是为了进行骨髓瘤相关医药资讯宣传。如无意中侵犯了您的权益,请联系我们,我们将予以删除。
2020年5月28日,葛兰素史克(GSK)公司宣布,其靶向B细胞成熟抗原(BCMA)的抗体偶联药物(ADC)belantamab mafodotin,在临床试验DREAMM-2和DREAMM-6中,进一步证明了其治疗复发/难治性多发性骨髓瘤(R/R MM)患者的潜力。目前,该疗法的生物制品许可申请(BLA)正在接受美国FDA的审评(相关阅读:GSK靶向BCMA的ADC药物获优先审评资格,治疗多发性骨髓瘤)。

多发性骨髓瘤是由于骨髓中的浆细胞癌变而造成的。浆细胞的异常增生会影响正常血细胞的生成,导致骨骼、免疫系统和肾脏受到损伤。虽然有多种疗法可以有效治疗多发性骨髓瘤,但是通常肿瘤细胞会对已有疗法产生抗性并且复发。因此,开发创新疗法至关重要。
Belantamab mafodotin是GSK公司的重点研发项目之一。它将人源化抗BCMA抗体与细胞毒性剂连接在一起。通过靶向BCMA将细胞毒性剂特异性送入MM细胞中起到杀伤癌细胞的作用。BCMA是近年来非常热门的靶点之一,它是一种跨膜糖蛋白,属于肿瘤坏死因子(TNF)受体超家族,又被称为TNFRSF17或CD269。这一蛋白的重要特点是它在所有MM细胞上高度表达,而且它不在其它正常组织中表达(除了浆细胞)。因此,这一靶点成为多家医药公司和研究机构开发治疗R/R MM患者的热门靶点。此前,belantamab mafodotin已获得美国FDA授予的突破性疗法认定和优先审评资格。
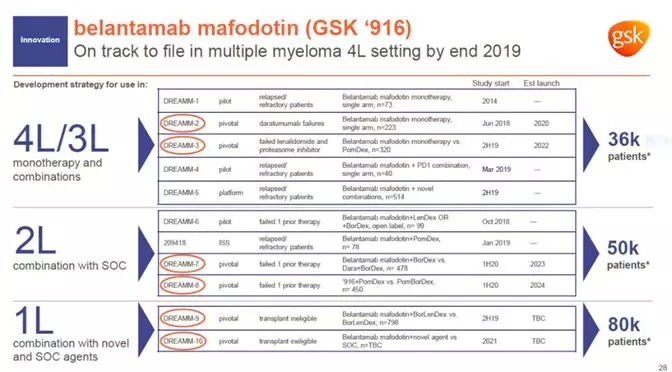
▲Belantamab mafodotin是GSK寄予厚望的重点研发项目(图片来源:参考资料[2])
先前已接受过免疫调节剂,蛋白酶体抑制剂和抗CD38抗体治疗的R/R MM患者参与了名为DREAMM-2的研究,该研究的13个月随访数据显示,接受2.5 mg/kg剂量belantamab mafodotin单药治疗的患者的中位缓解持续时间(DoR)为11个月,中位总生存期(OS)为14.9个月。总缓解率(ORR)为32%,与治疗6个月时的数据保持一致。在获得缓解的患者中,大多数(58%)患者取得了非常好的部分缓解,还包括2例严格的完全缓解和5例完全缓解。
名为DREAMM-6的研究评估了belantamab mafodotin联合硼替佐米/地塞米松(BorDex)治疗既往接受一线治疗后病情仍难以控制或复发患者的疗效。在该试验的早期分析中,这一组合疗法的治疗使患者的ORR达到78%,其中50%达到非常好的部分缓解,28%达到部分缓解。
“DREAMM-2研究的最新结果进一步表明了belantamab mafodotin的治疗潜力,有助于解决多发性骨髓瘤患者的重大未满足需求,”GSK高级副总裁兼肿瘤研发部主任Axel Hoos博士说:“我们对DREAMM-6研究的这些初步结果感到鼓舞,该研究显示了belantamab mafodotin的联合疗法在早期多发性骨髓瘤患者中的治疗潜力,我们期待获得并与大家分享该试验的完整数据。”
|
|